Spectroscopie
Ce chapitre est la liaison entre le cours des ondes (physiques) et celui des molécules organiques (chimie). On analyse un milieu chimique à l’aide de l’étude de spectre d’ondes.
Etude des particules
Une particule s’identifie toujours avec sa masse (exprimée en unité de matière u) et son énergie (exprimée en electron-Volt).
- (énergie d’un électron accéléré par une tension d’1V)
Ces deux valeurs relatives permettent de mieux se représenter les grandeurs liées aux particules.
Mais dans les exercices, il faut parfois multiplier masse et l’énergie par ces constantes pour les convertir dans les grandeurs standards (kg, J) et ainsi les utiliser dans des formules.
Exemple pour calculer la puissance P en Watts (W), on doit utiliser l’énergie E en Joules (J)
- Constante d’Avogadro
- Lorsque l’on étudie les entités élémentaires, on introduit le nombre d’Avogadro qui correspond au nombre d’entités chimiques qui se trouvent dans une mole.
- On a donc la formule suivante pour déduire le nombres d’entités chimiques d’un échantillon
- Photon
- Particule élémentaire sans masse ni charge électrique. Elle est associée aux ondes électromagnétiques/radio.
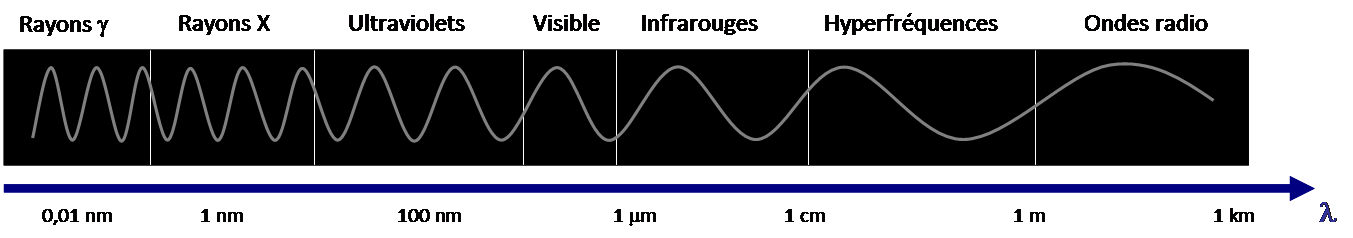
Spectre électromagnétique
Le spectre électromagnétique est constitué de plusieurs niveaux classés selon la longueur d’onde :
- Ultraviolet (UV) de 200 nm à 400 nm
- Visible de 400 nm (violet) à 800 nm (rouge)
- Infrarouge (IR) de 2,5µm à 17µm
- Hyperfréquences RMN (Résonnance Magnétique Nucléaire) de de 0,1 m à 1 m
- Longueur d’onde
- La longueur d’onde est l’équivalent spatiale de la période temporelle T. Les deux grandeurs sont proportionnelles avec la célérité de l’onde c. On peut aussi utiliser la fréquence de l’onde f (Hz).
Analyse spectrale d’une onde
- Spectroscopie
- Méthode expérimentale permettant d’identifier des espèces chimiques dans un milieu. Pour cela, on utilise un spectrophotomètre pour mesurer la différence d’intensité d’une radiation avant () et après passage à travers ce milieu ().
- La spectroscopie permet d’identifier les ondes et la radioactivité.
Il existe trois types d’analyse spectrale, selon les longueurs d’ondes étudiées.
Spectres UV-visible
- Absorbance A
- Il s’agit de la capacité de la solution/milieu à absorber une radiation.
Pour les spectres UV-visible, on représente l’absorbance en fonction de la longueur d’onde.
Principe et interprétation : On fait passer une radiation électromagnétique à travers une solution, certaines longueurs d’ondes sont absorbées par la solution permettant d’identifier différents éléments caractéristiques
- Un groupe carbonyle
- Un groupe hydroxyle
- Une liaison C=C
Dans le visible, on peut aussi faire une analyse à l’oeil nu, en fonction de la couleur du milieu. Une absorption des photons bleus de longueur d’onde entraîne la coloration du mileu en jaune-orangé, la couleur opposé dans le cercle chromatique.
Spectres IR
- Transmittance T
- Il s’agit de la fraction d’intensité de la radiation qui traverse le milieu. On peut l’exprimer sous forme de pourcentage.
- Si on a un grande absorbance (absorption des ondes), alors la transmittance (pourcentage des ondes qui “passent”) sera plus faible.
Pour le spectre Infrarouge, on représente la transmittance en fonction de la longueur d’onde.
Principe et interprétation : On fait passer une lumière IR à travers un échantillon, certaines liaisons de la molécule absorbent de l’énergie et changent de fréquence de vibration, faisant apparaître des bandes dans le spectre. On interprète donc les pics descendants dont la valeur correspond à certains types de liaisons.
Spectres RMN du proton
- Déplacement chimique
- C’est une grandeur basé sur des fréquences de résonance, fréquence nécessaire pour faire passer un proton dans un état d’énergie plus élevé.
- Elle s’exprime en ppm (parties par millions).
- Protons équivalents
- Deux protons sont équivalents s’ils sont liés avec le même carbone C.
- Les protons équivalents ont le même déplacement chimique .
Comme son nom l’indique, ce spectre permet d’étudier le proton (), par conséquent de mettre en évidence les signaux de groupes hydrogénés. On représente le déplacement chimique orienté de la droite vers la gauche.
Sur ce graphe on observe :
- Des pics qui correspondent aux groupes hydrogénés (rouge).
- Une courbe d’intégration qui subit des échelons à chaque pics (bleu).
La molécule étudiée sur le graphe est l’éthanol. On peut alors faire 3 types d’interprétations :
Chaque groupe de pics correspond à un groupe hydrogéné. Ici on a trois groupes d’hydrogènes équivalents caractérisés par des couleurs différentes sur la molécule.
Selon le nombre d’hydrogènes qui sont voisins du groupe étudié, on aura une multiplicité de un ou plusieurs pics sur le même déplacement chimique :
- singulet (si 0 voisins)
- doublet (si 1 voisin)
- triplet (si 2 voisins)
- quadruplet (si 3 voisins)
Pour l’éthanol, on a les correspondances suivantes :
- En rouge : , car deux voisins H bleus
- En bleu : car trois voisins H rouges
- En vert : , car pas de voisins H
Le rapport entre deux échelons de la courbe d’intégration indique le rapport du nombre d’hydrogènes entre les groupes. Si bien que l’on a les égalités suivantes entre les “longueurs de pentes” et le nombre d’atomes H de chaque groupe. Les couleurs correspondent au schéma de l’éthanol ci-dessus.




